Tổng hợp bởi ThS.BS. Đinh Thanh Nhân
Khoa Phụ sản – Bệnh viện Gia Đình
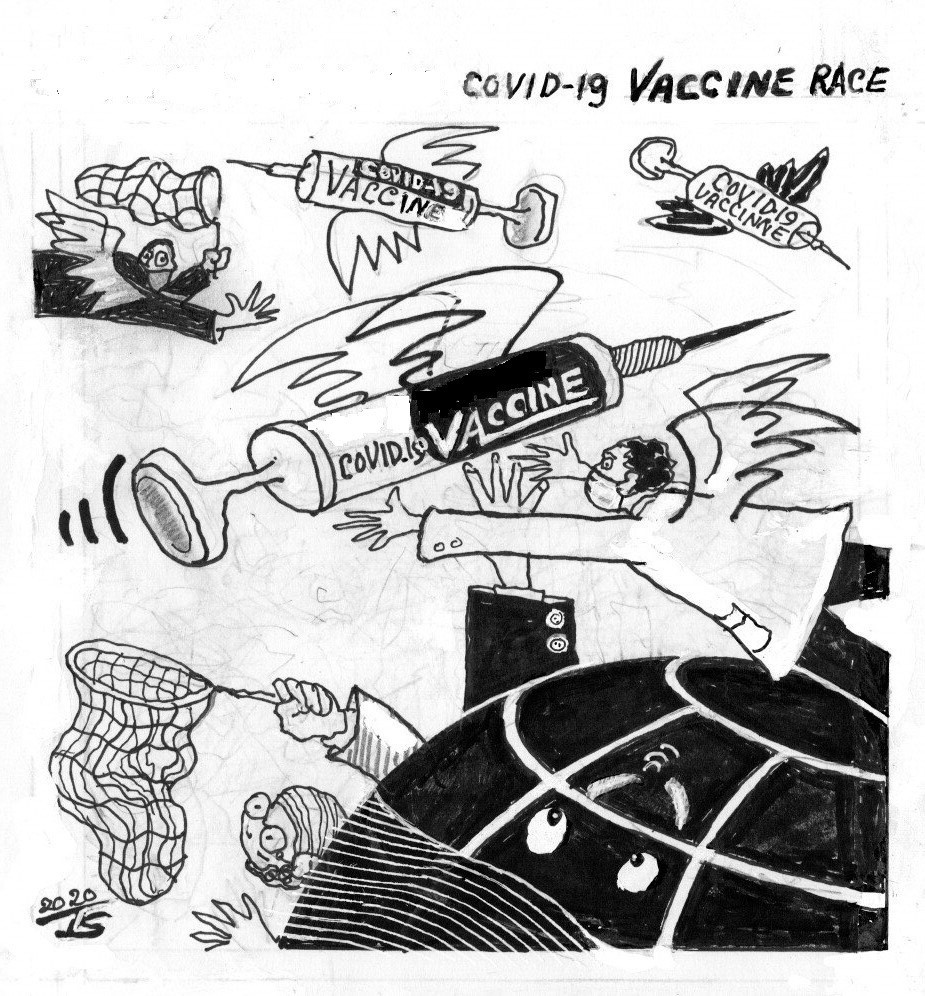
Cuộc chạy đua toàn cầu về vaccine COVID-19 đang diễn ra với tốc độ chưa từng có, được thúc đẩy bởi áp lực dư luận và xung đột chính trị. 7 “ứng viên” vaccine đã được thử nghiệm lâm sàng trên người và gần 70 vaccine nữa đang được triển khai.
ChAdOx1 nCoV-19, một loại vaccine đang được Đại học Oxford (Vương quốc Anh) phát triển cùng với công ty dược phẩm AstraZeneca, đã cho thấy những kết quả sơ bộ đầy hứa hẹn trong thử nghiệm lâm sàng pha 1/2. ChAdOx1 nCoV-19, còn được gọi là vaccine AZD1222, đã được chứng minh là an toàn, chỉ có một số tác dụng phụ và gây ra các đáp ứng miễn dịch mạnh. Nó gây ra đáp ứng tế bào lympho T đạt đỉnh sau 14 ngày tiêm chủng và đáp ứng kháng thể trong vòng 28 ngày [1]. Vaccine này đã được thử nghiệm so với vaccine liên hợp viêm màng não do não mô cầu ở 1.077 người trưởng thành khỏe mạnh (18 – 55 tuổi) từ 5 bệnh viện ở Vương quốc Anh và không có tiền sử mắc COVID-19. Họ được tiêm vaccine ChAdOx1 nCoV-19 (n = 543) hoặc vaccine Viêm màng não do não mô cầu ở nhóm chứng (n = 534). ChAdOx1 nCoV-19 cho thấy mức độ an toàn và khả năng dung nạp ở mức chấp nhận được, với đau đầu và mệt mỏi là những phản ứng phổ biến nhất được báo cáo. Không có tác dụng phụ nghiêm trọng nào liên quan đến ChAdOx1 nCoV-19.
Tiến sĩ Andrew Pollard, trưởng nhóm nghiên cứu và là giáo sư về nhiễm trùng và miễn dịch ở trẻ em của Đại học Oxford cho biết, kết quả này “đáng khích lệ và là một cột mốc quan trọng” trong việc tìm kiếm vaccine COVID-19. ChAdOx1 nCoV-19 được tạo ra từ một phiên bản suy yếu của adenovirus, một loại virus cúm thông thường gây nhiễm trùng ở tinh tinh. Virus đã được biến đổi gen để mã hóa cho protein đột biến của virus SARS-CoV-2.
Tuy nhiên, tiến sĩ Sarah Gilbert, giáo sư về vaccine học của Đại học Oxford và là đồng tác giả của nghiên cứu về ChAdOx1 nCoV-19, cho biết kết quả này tuy đáng khích lệ nhưng không nên bị thổi phồng quá sớm. Cô nhận xét: “Còn quá sớm để nói… khó khăn là chúng ta không biết đáp ứng miễn dịch đó cần phải mạnh đến mức nào. Chúng tôi không thể biết, chỉ bằng cách xem xét các đáp ứng miễn dịch, liệu vaccine này có bảo vệ được con người hay không?” Cách duy nhất để tìm hiểu là thực hiện các thử nghiệm pha III và “đợi những người bị nhiễm bệnh để biết liệu vaccine có thể hoạt động hay không” – cô nói thêm.
Nhóm nghiên cứu hiện đang tiến hành thử nghiệm pha III, thu nhận 30.000 bệnh nhân. Tốc độ mà vaccine đã đạt được trong quá trình thử nghiệm là khá ấn tượng. Những gì thường mất nhiều năm, giờ chỉ còn vài tháng. Nếu thành công, chương trình của Đại học Oxford sẽ đi trước tất cả các vaccine COVID-19 khác đang được phát triển. “Tuy nhiên, để bất kỳ loại vaccine nào trở nên hữu ích, chúng ta không chỉ cần các nghiên cứu lớn hơn ở những nơi COVID-19 vẫn ở tỉ lệ cao. Chúng tôi cần phải chắc chắn một cách hợp lý rằng tác dụng bảo vệ kéo dài trong một thời gian đáng kể” – giáo sư Stephen Evans từ Trường Vệ sinh và Y học Nhiệt đới London (Vương quốc Anh), người không tham gia nghiên cứu đã nhận xét. Và, “thử nghiệm cũng nên bao gồm những người trên 55 tuổi.”
Trong khi đó, kết quả sơ bộ từ thử nghiệm pha I/II đang diễn ra của Đức đối với vaccine RNA thông tin, BNT162b1, của công ty dược phẩm Pfizer và BioNTech, ủng hộ những phát hiện tích cực từ thử nghiệm tại Mỹ. BNT162b1, nhắm mục tiêu RBD*SARS-CoV-2, tạo ra các đáp ứng kháng thể trung hòa ở người vượt quá mức được quan sát thấy trong huyết thanh của bệnh nhân đang hồi phục ở liều thấp [2].
Những “ứng viên lớn” khác như công ty công nghệ sinh học Moderna (Hoa Kỳ) và Viện Dị ứng và Bệnh Truyền nhiễm Quốc gia Hoa Kỳ (NIAID), đang tận dụng công nghệ RNA thông tin mới hơn để phát triển vaccine COVID-19. Dữ liệu ban đầu về 45 người trưởng thành khỏe mạnh đầu tiên (18 – 55 tuổi) đăng ký tại các địa điểm của Đại học Seattle và Emory ở Atlanta (Hoa Kỳ), đã được chủng ngừa 2 lần, cách nhau 28 ngày, với vắc-xin mRNA-1273 COVID-19 (liều 25 μg, 100 μg, hoặc 250 μg), cho thấy vắc-xin gây ra các đáp ứng miễn dịch kháng SARS-CoV2. Không có thử nghiệm nào giới hạn mối quan tâm về an toàn được xác định [3].
Trong một bài bình luận liên quan, tiến sĩ Penny Heaton thuộc Viện Nghiên cứu Y khoa Bill & Melinda Gates ở Cambridge, Massachusetts (Hoa Kỳ) cho biết thế giới đã cung cấp bằng chứng về việc nén thời gian 3 – 9 năm điển hình của vắc-xin thành 6 tháng [4]. Mặc dù dữ liệu có vẻ đầy hứa hẹn, bà cảnh báo rằng vẫn còn nhiều việc phải làm, một phần vì liều 250 μg có liên quan đến các tác dụng phụ toàn thân nghiêm trọng mà không làm tăng hiệu quả vượt trội so với liều 100 μg. Bà nói: “Cần thận trọng khi đánh giá các liều từ 100 μg trở xuống để xác định phác đồ cung cấp đánh giá về lợi ích – nguy cơ phù hợp nhất cho loại vắc-xin này. Một thử nghiệm pha 3 đã được lên kế hoạch đối với vắc-xin mRNA SARS-CoV-2 sắp diễn ra.”
Các chuyên gia không dự đoán sẽ phê duyệt đầy đủ vaccine trước đầu năm 2021. Nhưng nếu vaccine có trong tay, liệu chúng ta có đủ không? Bất kỳ loại vaccine nào cũng sẽ phải được phân phối trên toàn cầu để dập tắt đại dịch, khi ấy các nước giàu khởi động lại nền kinh tế của họ trong khi người dân từ các nước nghèo lại bị bỏ rơi.
Nguồn:
1. Folegatti PM, Ewer KJ, Aley PK, et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet. 2020. doi: 10.1016 / S0140-6736 (20) 31604-4
2. Mulligan MJ, Lyke KE, Kitchin N, et al. Phase 1/2 Study to Describe the Safety and Immunogenicity of a COVID-19 RNA Vaccine Candidate (BNT162b1) in Adults 18 to 55 Years of Age: Interim Report. 2020. doi: 10.1101/2020.06.30.20142570.
3. Jackson LA, Anderson EJ, Rouphael NG, et al. An mRNA vaccine against SARS-CoV-2 – Preliminary report. N Engl J Med, 2020. doi: 10.1056/NEJMoa2022483.
4. Heaton PM. The Covid-19 vaccine-development multiverse. N Engl J Med, 2020. doi: 10.1056/NEJMe2025111.